CTDの作成
サービス内容
お客様ごとに異なる様式や当局のガイドラインに準じて、CTDの臨床パートを作成します。
生物薬剤学パート(CTD2.7.1/2.5.2)や臨床薬理パート(CTD2.7.2/2.5.3)、より上位のCTD2.5.1/2.5.6を含めて、すべてのパートを作成可能です。また、CTD2.7.6は、シノプシス・ベースの作成から、CSRの必要箇所を編集した作成まで、ご要望に応じて対応いたします。
CTD5.2 の臨床試験一覧表や、CTD5.3.7 の被験者一覧表の作成・編集も可能です。
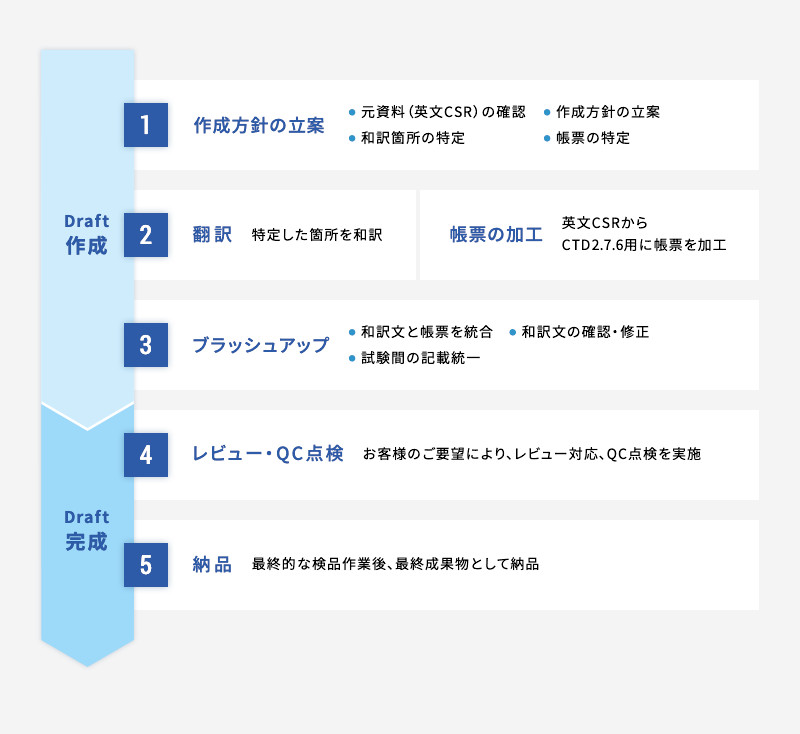
CTD2.7.6の作成工程と作成期間
英文CSRを元資料とするCTD2.7.6(仕上がり20~30ページ程度)の場合、1試験あたりのDraft作成期間(レビュー・QC点検は含まない)の目安は、1試験目は約4週間(作成方針を確認しながら進めるため)、2試験目以降は約2週間(作成方針決定後は作業がスムーズになるため)です。下記の「CTD2.7.6 Draft作成プロセス」をご参照ください。
ご要望により、複数試験の作成を並行して進めることで、作成期間全体を短縮することも可能です。複数のメディカルライターが作業を分担する場合は、社内のシニア・ライターが品質管理を徹底し、案件全体の整合性・一貫性と成果物の品質を保持します。
CTD2.7.6 Draft作成プロセス